纯液体、理想溶液和非理想溶液
Chmical Potential of Pure Liquids
pure liquids与其自身vapour达平衡时,两者的chemical potential相等.
Input:pure liquid与vapour处于equilibrium
Algorithm:平衡时纯液体的化学势等于其蒸汽的化学势 $\mu^*(l) = \mu^*(g)$
将vapour pressure of pure liquid标记为 $p^*$,代入蒸汽相化学势公式;
替换分压 $p$ 为 $p^*$,得到纯液体化学势;
根据热力学基本方程,等温(\(dT=0\))下\(dG_m = V_m dp\),其中\(V_m\)为理想气体的摩尔体积,由理想气体状态方程\(V_m = \frac{RT}{p}\)代入,得:\(d\mu(g) = \frac{RT}{p} dp\)
积分结果为:\(\int_{\mu^\ominus(g)}^{\mu^*(g)} d\mu(g) = RT \int_{p^\ominus}^{p^*} \frac{dp}{p}\)
Output:$$\mu^*(l) = \mu^\ominus(g) + RT\ln\left(\frac{p^*}{p^\ominus}\right)$$
其中:\(\mu^*(l)\)(pure liquid chemical potential)、\(\mu^\ominus(g)\)(standard chemical potential of vapour,蒸汽相标准化学势)、\(p^*\)(vapour pressure of pure liquid)、\(p^\ominus\)(standard pressure,通常为 1 bar);\(RT \ln\left(\frac{p^*}{p^\ominus}\right)\):“偏离标准状态” 的修正项,反映蒸汽压\(p^*\)与标准压\(p^\ominus\)的差异对化学势的影响.
这种处理,利用相平衡将难以直接测量的纯液体化学势 \(\mu^*(l)\) 转化为可通过蒸汽压计算的蒸汽相化学势 \(\mu^*(g)\).
Ideal Solutions
intermolecular interactions
Raoult’s Law
Ideal Solutions中,某组分的蒸气压$p_A$等于其纯态蒸气压$p_A^{*}$与溶液中摩尔分数$x_A$的乘积:
$$p_A = x_A p_A^*$$
组分 A 的摩尔分数$x_{A}$是组分 A 的物质的量$n_{A}$ 与混合物总物质的量$n_{A}+n_{B}$ 的比值,namely:$$x_{A}=\frac{n_{A}}{n_{A}+n_{B}}$$
同时满足$x_{A}+x_{B}=1$.
所有组分的摩尔分数之和为 1,某一组分的摩尔分数变化必然伴随其他组分的反向变化;因此,Raoult’s Law反映了Ideal Solutions中组分蒸气压随组成的变化,加入溶质B使$x_A$减小,则$p_A$降低.
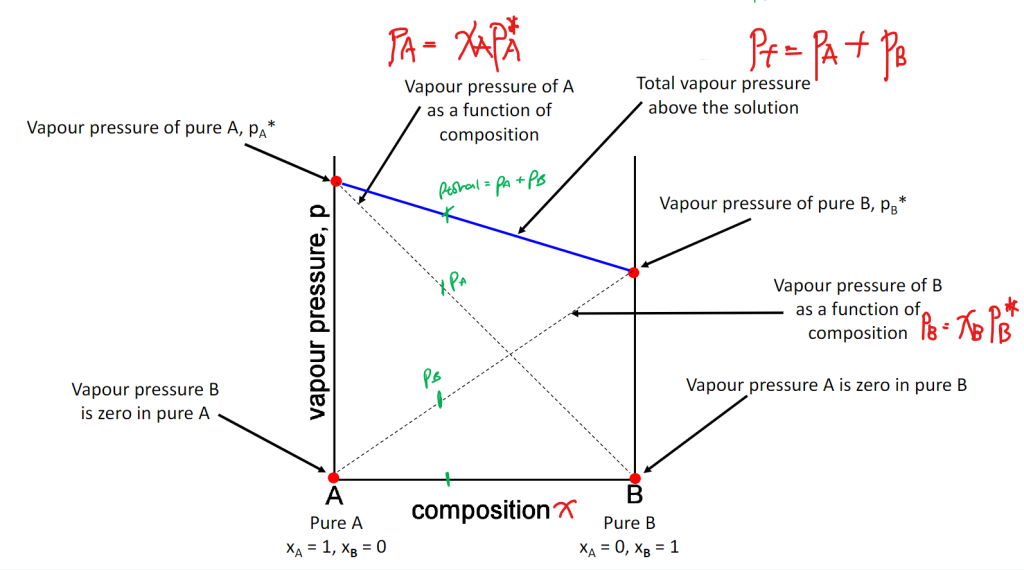
液相分子向气相的蒸发倾向被削弱;要么是难挥发溶质的 “物理阻碍 + 浓度稀释”,要么是非理想溶液中 “分子间强相互作用的束缚”,最终导致气相中分子数减少,蒸气压降低,也就是蓝线呈现出来的下降趋势.
Non-ideal Solutions
Deviation
非理想溶液中A-B相互作用与A-A, B-B差异显著,导致蒸气压偏离Raoult’s Law的预测:
- Positive Deviation
A-B 作用 < A-A/B-B 作用,分子易逸出,$p_A > x_A p_A^*$
如丙醇-水
- Negative Deviation
A-B 作用 > A-A/B-B 作用,分子难逸出,$p_A < x_A p_A^*$
如三氯甲烷 – 乙醚,形成氢键
Tips
溶质少,即$x_A$大,导致 $p_A$大:这是拉乌尔定律的正常现象,不是偏差;
溶质$x_A$ 固定,但$p_A$比$x_A p_A^*$大:这才是正偏差,根源是分子间作用变弱
Activity and Activity Coefficient
为将理想溶液化学势公式推广到非理想溶液,引入activity, $a_A$, 修正摩尔分数:
$$a_A = \gamma_A x_A$$
其中$\gamma_A$为activity coefficient,反映非理想程度:
- 理想溶液: $\gamma_A = 1$,$a_A = x_A$;
- 正偏差:$\gamma_A > 1$;
- 负偏差:$\gamma_A < 1$
非理想溶液组分化学势公式:
$$\mu_A(l) = \mu_A^{(l)} + RT\ln a_A = \mu_A^{(l)} + RT\ln(\gamma_A x_A)$$
Ideal Solubility & Thermodynamics of Mixing Ideal Solutions
Ideal Solubility
溶质化学势
理想溶解度指纯固体solute与溶液中溶质达平衡时的溶解度(饱和溶解度),此时纯固体化学势等于溶液中溶质化学势:
$$\mu_B^*(s) = \mu_B(sol)$$
其中$\mu_B^*(s)$为纯固体 B 的化学势
理想溶解度计算公式
结合理想溶液溶质化学势公式$mu_B(sol) = \mu_B^*(l) + RT\ln x_B$,代入平衡判据得:
$$\mu_B^(s) = \mu_B^(l) + RT\ln x_B$$
整理得:
$$\ln x_B = -\frac{\Delta_{fus} G}{RT}$$
其中$\Delta_{fus} G = \mu_B^{(l)} – \mu_B^{(s)}$为固体 B 的Gibbs energy of fusion.
Colligative Properties
Colligative Properties:仅依赖溶液中粒子相对数量,与粒子种类无关的性质,包括:lowering of vapour pressure, elevation of boiling point, depression of freezing point, osmotic pressure.
Elevation of Boiling Point
Depression of Freezing Point
纯物质的Melting Point (T_m))是 solid 和 liquid 的 Chemical Potential (\mu))相等的温度;当溶液中加入solute后,liquidoid(溶液)的化学势降低(Solute particles增加了体系的entropy,使gibbs free energy降低),但solidoid(Solid of pure solvent)的化学势不变
此时,只有降低温度,才能让固相的化学势也降低到与溶液的化学势相等,因此溶液的熔点 $T_{m,\text{sol}}$ 比纯溶剂的熔点 $(T_{m,\text{pure}}$ 低
熔点降低的程度可用以下公式定量描述:$$\Delta T_m = T_{m,\text{pure}} – T_{m,\text{sol}} = K_f \cdot b$$
其中:
- $\Delta T_m$:熔点降低值(纯溶剂与溶液的熔点差)
- (K_f):Freezing Point Depression Constant,仅与溶剂的性质有关(如溶剂的摩尔凝固焓、摩尔质量等)
- $b$:溶质的质量Molality,定义为 “溶质的物质的量与溶剂的质量(kg)之比”
0 条评论