定义
纯溶剂的饱和蒸气压
在密闭容器中,液体表面分子将蒸发,液面上方的空间被液体分子占据.
随着上方空间里液体分子个数的增加,蒸气的密度增大,蒸气的压强也逐渐增大.
当凝聚速率和蒸发速率相等时,上方空间的蒸气密度不再改变,蒸气压强也不再改变,蒸气达到饱和.
体系处于一种动态的气-液平衡:
$$H_2O(l)\rightleftharpoons H_2O(g)$$
此时,饱和蒸气压所具有的压强叫作改温度下液体的饱和蒸气压,简称蒸气压,用$p^{*}$表示.
溶液的饱和蒸气压
当溶液中溶有难挥发的溶质时,则有部分溶液表面被这种溶质分子所占据.
于是,溶液中,在单位表面上单位时间内蒸发的溶剂分子的数目$N$要小于纯溶剂蒸发的分子数目$N^{*}$.
当凝聚的分子数目与蒸发的分子数目$N$相等时,实现平衡,蒸气的密度及压强不会改变
这时蒸气的密度及压强均达不到使凝聚分子数为$n^{*}$,所以溶液蒸气的密度和压强分别小于纯溶剂蒸气的密度和压强.
结论是溶液的饱和蒸气压$p$小于纯溶剂的饱和蒸气压$p^{*}$.
Raoult定律(基础内容)
在一定温度下,稀溶液的饱和蒸气压等于纯溶剂的饱和蒸气压与溶剂的摩尔分数之和,即
$$p=p^{*}\cdot x(剂)$$
Raoult定律(第二种表示形式)
用$\Delta p$表示稀溶液饱和蒸气压下降值,则有
$$
\begin{aligned}
\Delta p=&p^{*}-p\\ =&p^{*}-p{*}\cdot x(剂)\\ =&p^{*}[1-x(剂)]
\end{aligned}
$$
故有
$$\Delta p=p^{*}\cdot x(质)$$
结合$x(质)\approx k’b$,则对于稀的水溶液,有
$$\Delta p =p^{*}\cdot k’b$$
一定温度下,$p^{*}$为常数.
令$k=p^{*}\cdot k’$,于是有
$$\Delta p=k\cdot b$$
式中$k$为常数,不同溶剂的$k$值不同.
结论是稀溶液饱和蒸气压下降值,与稀溶液的质量摩尔浓度成正比.
测定
稳态法/静态法
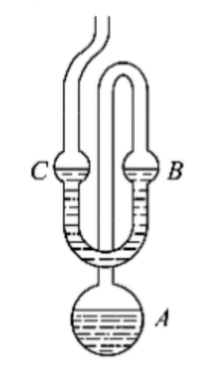
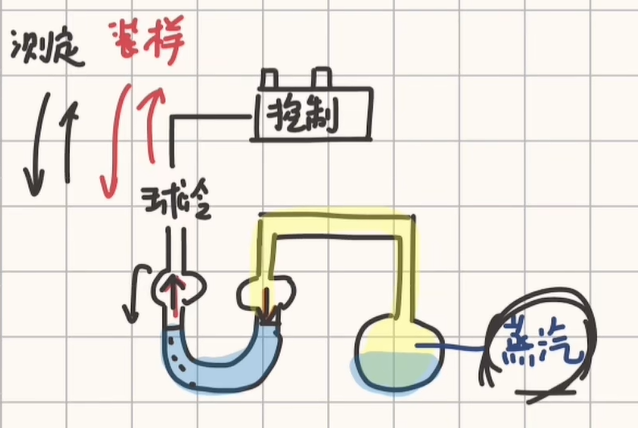
通入空气时,如果有三个阀门,必须用平衡阀慢慢通入空气;如果有两个阀门,则冷却到液面相平为止,注意不要让空气过去.
其它方法
- 实验室:雷德法
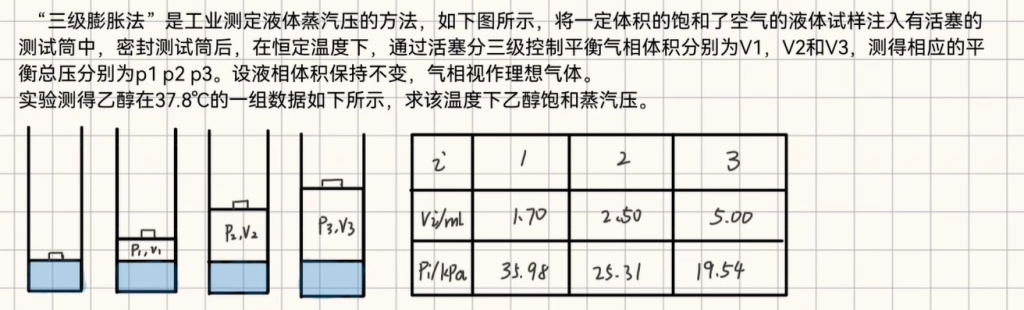
- 工业:三级膨胀法
Refrence
0 条评论