- $ReO3$ Structure
- Perovskite Structures, ABX₃
- Spinel Structures $\ce{AB2X4}$
- 五、考试公式总结表(Formula Summary for Exam)
- 六、考试易错点总结(Common Mistakes in Exam)
- 文档核心知识点梳理
本讲座聚焦三类核心Functional Structures,分别是Rhenium Trioxide $ReO3$、Perovskite Structures, $ABX3$ 和Spinel Structures $AB2X4$.
$ReO3$ Structure
Basic Structural Features
- Unit Cell Type:Cubic Unit Cell,是最简单的功能结构之一.
从化学计量上来看,$\ce{AX3}$属于functional struture的类型定义,按照化学计量比描述;而基于晶胞几何堆积方式也就是Bravis点阵的几何类型来看,则属于Simple Cubic.
Tips:堆积方式只看骨架原子的位置,填充的原子不管在哪,都不改变堆积类型
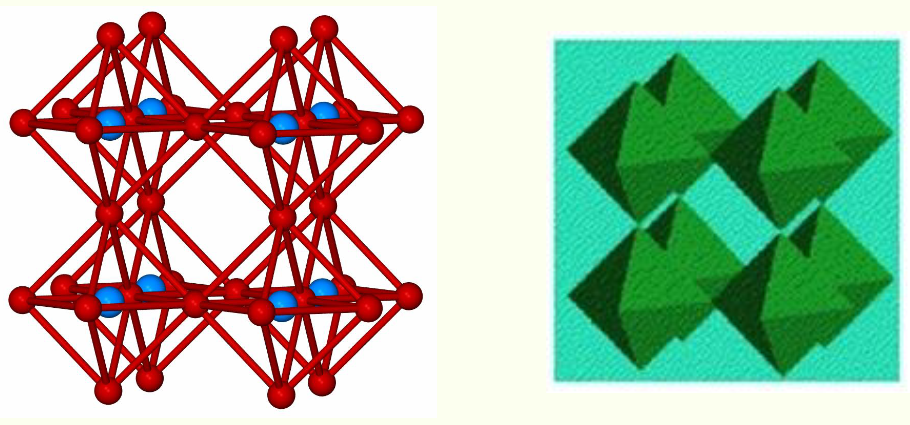
- Atomic Positions
- Rhenium (VI) Ions:位于立方体的 8 个顶点,每个顶点原子贡献 1/8 到单个晶胞,因此晶胞中 Re⁶⁺总数为 \(8 \times 1/8 = 1\)
- Oxide Ions:位于立方体的 12 条棱,每条棱原子贡献 1/4 到单个晶胞,因此晶胞中 O²⁻总数为 \(12 \times 1/4 = 3\),最终化学式为 $\ce{ReO3}$
- Key Structural Characteristics
- 晶胞内部存在大量空穴(space in the unit cell),可容纳额外离子(如 Na⁺),进而形成新化合物(如钨青铜)
- 结构本质是 vertex-linked $\ce{ReO6}$ octahedra:每个 Re⁶⁺被 6 个 O²⁻包围形成正八面体,相邻八面体通过顶点 O²⁻连接,构成三维框架
Analogous Structures & Derivatives
- $\ce{MF3}$型化合物:当 M 为铝(Al)、钪(Sc)、铁(Fe)、钴(Co)、铑(Rh)、钯(Pd) 时,MF₃会形成与 $\ce{ReO3}$ 相同的结构(如 ScF₃、FeF₃)
- 钨青铜(Tungsten Bronzes, NaₓWO₃):ReO₃晶胞中心的空位(large vacancy in the centre) 可插入 Na⁺等低价阳离子,形成非化学计量化合物 NaₓWO₃(x<1),这类材料具有金属导电性和变色特性(后续 Lecture 11 详细讲解)
Perovskite Structures, ABX₃
Perovskite structures 是材料科学中最重要的结构之一,原型为矿物 Calcium Titanate CaTiO₃,但大量人工合成的 ABX₃型化合物均具有此结构,且具备丰富的功能特性.
Composition & Classification
- General Formula:\(ABX_3\),其中:
- A-site Cation:通常为大尺寸阳离子(如 Ca²⁺、Sr²⁺、La³⁺、CH₃NH₃⁺),电荷可为 + 1、+2、+3
- B-site Cation:通常为小尺寸高电荷阳离子(如 Ti⁴⁺、Nb⁵⁺、Fe³⁺、Pb²⁺),电荷可为 + 3、+4、+5
- X-site Anion:常见为氧离子(O²⁻) 或氟离子(F⁻),电荷多为 – 1 或 – 2
- Typical Compounds:X 位离子(X-site Anion)A/B 电荷组合(A/B Charge Combination)实例(Examples)O²⁻A²⁺B⁴⁺SrTiO₃、BaTiO₃、CaTiO₃O²⁻A¹⁺B⁵⁺KTaO₃、KNbO₃O²⁻A³⁺B³⁺LaCrO₃、LaFeO₃、YNiO₃F⁻(当前研究热点)如 CsPbF₃、KMnF₃
Unit Cell Structure
钙钛矿存在两种等价的Primitive Cubic Unit Cell,均满足化学式 CaTiO₃(Z=1,Z 为晶胞中化学式单元数),这两种类型本质相同,结构完全相同,只是选取的中心不一样:
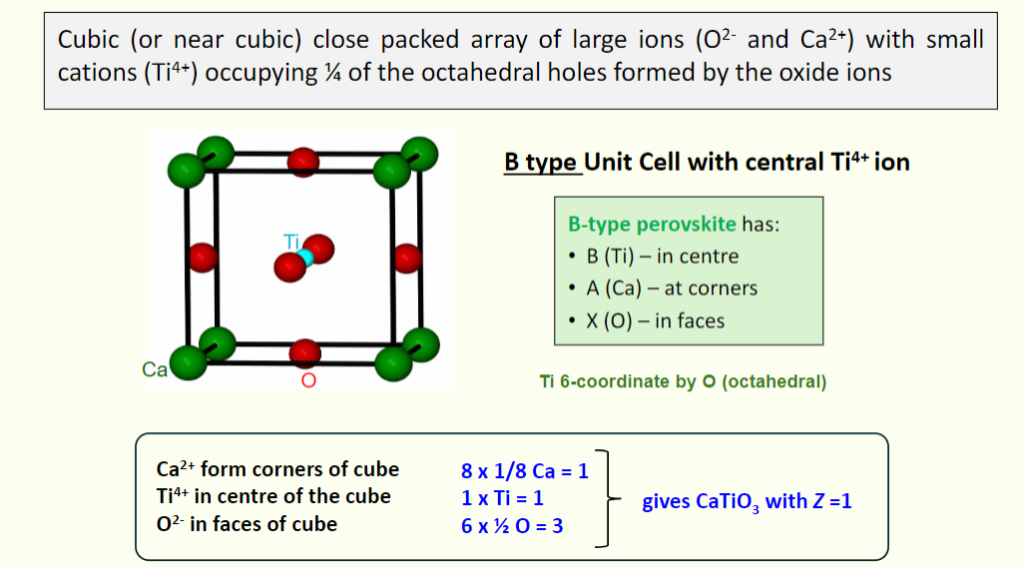
B-type Unit Cell
- 原子占位
- B 位离子(Ti⁴⁺):位于晶胞中心,贡献 1 个 Ti⁴⁺
- A 位离子(Ca²⁺):位于晶胞 8 个顶,总数 \(8 \times 1/8 = 1\) 个 Ca²⁺
- X 位离子(O²⁻):位于晶胞 6 个面心,总数 \(6 \times 1/2 = 3\) 个 O²⁻
- Coordination Environment
- Ti⁴⁺:被 6 个 O²⁻包围,形成octahedral coordination(配位数 6)
- Ca²⁺:被 12 个 O²⁻包围,形成cuboctahedral coordination(配位数 12)
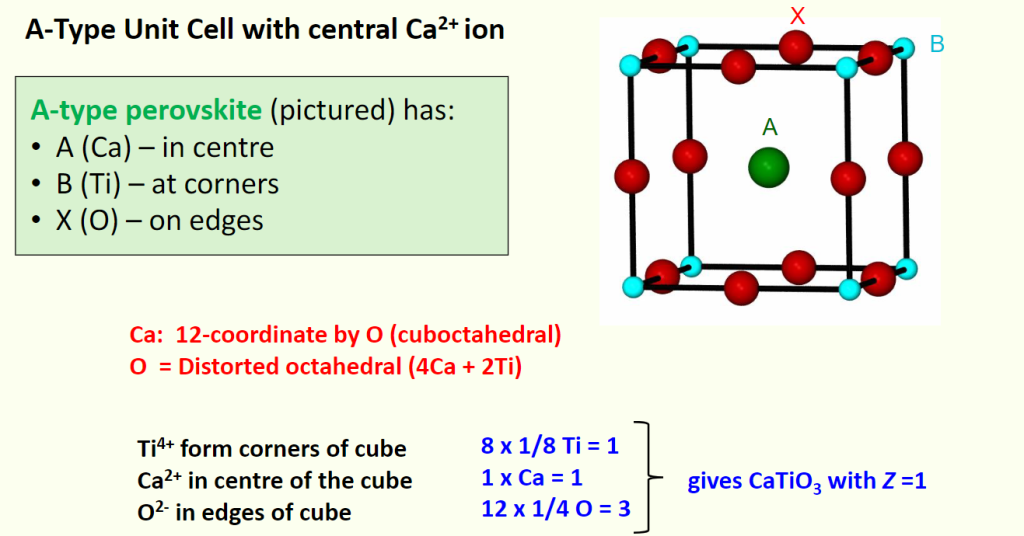
A-type Unit Cell
- 原子占位:
- A 位离子(Ca²⁺):位于晶胞中心,贡献 1 个 Ca²⁺
- B 位离子(Ti⁴⁺):位于晶胞 8 个顶点,总数 \(8 \times 1/8 = 1\) 个 Ti⁴⁺
- X 位离子(O²⁻):位于晶胞 12 条棱,总数 \(12 \times 1/4 = 3\) 个 O²⁻
- 配位环境:与 B 型一致,仅原子位置互换,两种晶胞完全等价
Structural Essence
钙钛矿结构的核心是 vertex-linked BO₆ octahedral framework:相邻 BO₆八面体通过顶点 O²⁻连接,形成三维网格,A 位离子填充在网格间隙中。这种框架具有flexibility,BO₆八面体可协同rotate/tilt cooperatively,导致结构畸变(如四方、正交对称)
结构稳定性:Goldschmidt Tolerance Factor, t
钙钛矿结构的稳定性由Tolerance Factor t判断,它描述 A、B、X 离子半径的匹配程度:
$$t = \frac{r_A + r_X}{\sqrt{2}(r_B + r_X)}$$
- 符号定义
\(r_A\) = A-site cation radius
\(r_B\) = B-site cation radius
\(r_X\) = X-site anion radius
- 稳定性规则
- 当 \(t \approx 1\) 时,结构为ideal cubic perovskite,最稳定
- 当 \(t \neq 1\) 时,结构发生畸变(distortion),对称性降低,形成rhombohedral、tetragonal或orthorhombic 结构(如 BaTiO₃在室温下为四方结构)
Ferroelectricity
Definition
铁电性是指材料在without external electric field的条件下自发产生 electric polarization 的特性,即材料本身存在electric dipole moment.
Mechanism
- B 位阳离子尺寸不匹配:当 B 位阳离子(如 Ti⁴⁺)尺寸过小,无法在 BO₆八面体中心对称存在
- 阳离子偏移(off-centre displacement):B 位阳离子向 BO₆八面体的顶点、面或棱偏移,导致正电荷中心与负电荷中心不重合,形成电偶极矩
- 偶极排列(dipole alignment):相邻晶胞的电偶极矩沿同一方向排列,使晶体整体产生净极化(net polarization)
Curie Temperature $T_c$
当温度高于 $T_c$ 时,钙钛矿发生phase transition,恢复为立方结构(无阳离子偏移),铁电性消失
示例:BaTiO₃的 Tc 约为 120℃,低于 120℃为铁电相(四方 / 正交 / 菱形),高于 120℃为顺电相(立方)
应用:Halide Perovskite Solar Cells
Material Composition
- 通式:\(ABX_3\),其中 X=Cl⁻、Br⁻、I⁻;A=Cs⁺、NH₄⁺、CH₃NH₃⁺,MA⁺;B=Pb²⁺、Sn²⁺
- 典型材料:CH₃NH₃PbI₃,MAPbI₃,是当前效率最高的卤化物钙钛矿
Advantages
- 制备简便:可通过solution precursors 或thermal evaporation 在低温(<150℃)下制备薄膜
- 载流子迁移率高:电子和空穴的mobility of electrons and holes 与昂贵的 III-V 族半导体(如砷化镓 GaAs)相当,而 GaAs 需高温制备单晶
- 效率高:钙钛矿太阳能电池的光电转换效率已突破 25%,接近商用硅电池
结构特点
- Methylamine cation(MA⁺)填充在 PbX₆ 八面体构成的框架间隙中,形成稳定的三维结构
Spinel Structures $\ce{AB2X4}$
尖晶石是一类重要的magnetic oxide structure,原型为矿物镁铝尖晶石(MgAl₂O₄),广泛应用于ferrites、催化剂等领域
1. 基本结构特征(Basic Structural Features)
- 通式:\(AB_2X_4\),其中:
- A 位阳离子:低价阳离子(如 Mg²⁺、Fe²⁺、Co²⁺),四面体配位(tetrahedral coordination)(配位数 4)。
- B 位阳离子:高价阳离子(如 Al³⁺、Fe³⁺、Cr³⁺),八面体配位(octahedral coordination)(配位数 6)。
- X 位阴离子:主要为 O²⁻(少数为 F⁻)。
- 典型化合物:MgAl₂O₄、Fe₃O₄(磁铁矿)、CoFe₂O₄(钴铁氧体)、NiFe₂O₄(镍铁氧体)。
2. 两种结构类型(Two Structural Types)
尖晶石分为正常尖晶石(Normal Spinel) 和反尖晶石(Inverse Spinel),核心区别是 A、B 阳离子的占位不同。
(1)正常尖晶石(Normal Spinel)
- 阴离子排列:O²⁻形成面心立方密堆积(FCC close-packed array)。
- 阳离子占位:
- A 位阳离子:填充 1/8 的四面体间隙(tetrahedral holes)(FCC 晶胞中四面体间隙共 8 个,填充 1 个)。
- B 位阳离子:填充 1/2 的八面体间隙(octahedral holes)(FCC 晶胞中八面体间隙共 4 个,填充 2 个)。
- 晶胞计算(Z=8):面心立方晶胞可分为 8 个小立方体(quadrants),最终晶胞含 8 个 A、16 个 B、32 个 O,即 8 个 AB₂X₄单元(如 Mg₈Al₁₆O₃₂ = 8MgAl₂O₄)。
- 示例:MgAl₂O₄(Mg²⁺占四面体间隙,Al³⁺占八面体间隙)。
(2)反尖晶石(Inverse Spinel)
- 定义:A 位阳离子与一半 B 位阳离子互换位置,化学式可表示为\(B(AB)X_4\)(即 1 个 B 占四面体间隙,1 个 A+1 个 B 占八面体间隙)。
- 形成原因:晶体场稳定化能(Crystal Field Stabilisation Energy, CFSE) 驱动 —— 部分阳离子(如 Fe²⁺、Ni²⁺)在八面体间隙中的 CFSE 远高于四面体间隙,会优先占据八面体间隙,迫使 B 位阳离子(如 Fe³⁺)进入四面体间隙。
- 示例:
- Fe₃O₄(磁铁矿):实际为 Fe²⁺Fe₂³⁺O₄,结构为 Fe³⁺(Fe²⁺Fe³⁺) O₄(Fe³⁺占四面体间隙,Fe²⁺+Fe³⁺占八面体间隙)。
- CoFe₂O₄、NiFe₂O₄:均为反尖晶石结构。
3. 关键概念:晶体场稳定化能(CFSE)与结构判断
CFSE 是过渡金属阳离子在晶体场中获得的额外能量,取决于离子的 d 电子构型(dⁿ)、晶体场类型(四面体 / 八面体)和场强(强场 / 弱场)。尖晶石中 O²⁻为弱场配体(weak-field ligand),CFSE 计算规则如下:
(1)弱场下 CFSE 计算公式
| 配位环境(Coordination Environment) | CFSE 公式(CFSE Formula) | 与八面体场分裂能(Δoct)的关系 |
|---|---|---|
| 四面体(Tetrahedral) | \(CFSE = -\frac{3}{5}\Delta_{tet}\) | \(\Delta_{tet} = \frac{4}{9}\Delta_{oct}\),故\(CFSE = -\frac{12}{45}\Delta_{oct}\) |
| 八面体(Octahedral) | \(CFSE = -\frac{2}{5}\Delta_{oct}\)(d⁶);\(CFSE = -\frac{6}{5}\Delta_{oct}\)(d⁸) | —— |
(2)结构判断示例:NiFe₂O₄(Ni²⁺d⁸,Fe³⁺d⁵)
- Ni²⁺的 CFSE:
- 四面体间隙:\(CFSE = -\frac{12}{45}\Delta_{oct}\)(≈-0.267Δoct)。
- 八面体间隙:\(CFSE = -\frac{6}{5}\Delta_{oct}\)(=-1.2Δoct)。
- 结论:Ni²⁺优先占据八面体间隙。
- Fe³⁺的 CFSE:
- d⁵构型在弱场下为高自旋,四面体和八面体 CFSE 均为 0(电子均匀分布,无额外能量),无占位偏好。
- 最终结构:Ni²⁺占据八面体间隙,迫使 1/2 Fe³⁺进入四面体间隙,形成反尖晶石 NiFe₂O₄ = Fe³⁺(Ni²⁺Fe³⁺) O₄。
4. 关键性质:磁性(Magnetism)
尖晶石的磁性由四面体间隙(T 位)和八面体间隙(O 位)中阳离子的自旋耦合(spin coupling) 决定,O²⁻可介导相邻阳离子的自旋相互作用。
(1)亚铁磁性(Ferrimagnetism)
- 机制:T 位与 O 位阳离子的自旋方向相反,但自旋磁矩大小不等,晶体整体存在净磁矩(net magnetic moment)。
- 示例:Fe₃O₄(T 位 Fe³⁺自旋向下,O 位 Fe²⁺+Fe³⁺自旋向上,总磁矩≠0)、CoFe₂O₄(用于磁记录介质)。
(2)反铁磁性(Antiferromagnetism)
- 机制:T 位与 O 位阳离子的自旋方向相反,且自旋磁矩大小相等,晶体整体无净磁矩。
- 示例:某些正常尖晶石(如 ZnFe₂O₄,Zn²⁺无未成对电子,T 位无磁矩,O 位 Fe³⁺自旋抵消)。
五、考试公式总结表(Formula Summary for Exam)
| 类别(Category) | 公式(Formula) | 符号说明(Symbol Explanation) | 应用场景(Application Scenario) |
|---|---|---|---|
| 戈尔德施密特容忍因子(Goldschmidt Tolerance Factor) | \(t = \frac{r_A + r_X}{\sqrt{2}(r_B + r_X)}\) | \(r_A\):A 位离子半径;\(r_B\):B 位离子半径;\(r_X\):X 位离子半径 | 判断钙钛矿结构稳定性(t≈1 为立方,t≠1 为畸变结构) |
| 晶胞原子数计算(Unit Cell Atom Count) | 1. ReO₃:Re⁶⁺=8×1/8=1;O²⁻=12×1/4=32. 钙钛矿(B 型):Ca²⁺=8×1/8=1;Ti⁴⁺=1;O²⁻=6×1/2=33. 尖晶石(Z=8):A=8;B=16;O=32 | —— | 验证晶胞化学式是否符合 ABX₃(钙钛矿)、AB₂X₄(尖晶石) |
| 弱场 CFSE 计算(Weak-field CFSE Calculation) | 1. 四面体:\(CFSE = -\frac{12}{45}\Delta_{oct}\)2. 八面体(d⁶):\(CFSE = -\frac{2}{5}\Delta_{oct}\)3. 八面体(d⁸):\(CFSE = -\frac{6}{5}\Delta_{oct}\)4. d⁵(弱场):CFSE=0 | Δoct:八面体场分裂能(Octahedral field splitting energy);Δtet:四面体场分裂能(Tetrahedral field splitting energy) | 判断尖晶石类型(正常 / 反尖晶石) |
| 反尖晶石化学式(Inverse Spinel Formula) | \(B(AB)X_4\) | 1 个 B 占四面体间隙;1 个 A+1 个 B 占八面体间隙 | 表示反尖晶石结构(如 Fe₃O₄=Fe³⁺(Fe²⁺Fe³⁺) O₄) |
六、考试易错点总结(Common Mistakes in Exam)
- 钙钛矿 A/B 型晶胞混淆:
- 易错点:误将 B 型晶胞(Ti 在中心)与 A 型晶胞(Ca 在中心)视为不同结构,实际两者仅原子位置互换,均为原始立方晶胞,Z=1。
- 应对:记住 “中心离子决定类型”——B 型中心是 B 位(如 Ti),A 型中心是 A 位(如 Ca),原子数计算均为 “顶点 1/8、面 1/2、棱 1/4、中心 1”。
- 戈尔德施密特容忍因子的应用误区:
- 易错点:认为 t=1 是钙钛矿形成的唯一条件,实际 t 在 0.75~1.0 之间均可形成钙钛矿(t<0.75 为钛铁矿结构,t>1 为萤石结构)。
- 应对:重点掌握 “t≈1→立方;t≠1→畸变”,而非 “t≠1→不能形成”。
- 铁电性与居里温度的关系混淆:
- 易错点:误认为 “温度越高,铁电性越强”,实际高于居里温度(Tc)时,铁电性消失(结构恢复立方,无阳离子偏移)。
- 应对:记住 “Tc 是铁电相(低温)与顺电相(高温)的分界点”。
- 正常 / 反尖晶石的判断错误:
- 易错点:忽略 CFSE 的影响,仅凭阳离子电荷判断(如认为 Fe₃O₄是正常尖晶石)。
- 应对:先计算阳离子的 CFSE(弱场下 d⁶、d⁸阳离子优先八面体间隙),再判断占位 ——CFSE 高的阳离子优先占八面体间隙,易形成反尖晶石。
- 亚铁磁性与反铁磁性的区别:
- 易错点:混淆 “自旋方向相反” 的结果,误认为两者均无净磁矩。
- 应对:核心区别是 “自旋磁矩大小是否相等”—— 相等→反铁磁性(无净磁矩);不等→亚铁磁性(有净磁矩)。
- 卤化物钙钛矿的组成误区:
- 易错点:忘记 A 位可含有机阳离子(如 CH₃NH₃⁺),仅认为是无机阳离子(如 Cs⁺)。
- 应对:记住 “杂化钙钛矿(有机 – 无机)是太阳能电池的核心材料”,通式中 A 可为有机阳离子(MA⁺、FA⁺)或无机阳离子(Cs⁺)。
- ReO₃与钙钛矿的结构联系:
- 易错点:忽略两者的衍生关系,ReO₃晶胞中心加一个阳离子(如 A⁺)即可形成钙钛矿结构(ABX₃,A 为中心阳离子,B 为 Re,X 为 O)。
- 应对:理解 “ReO₃是钙钛矿的‘框架前体’”,中心空位填充 A 位离子后形成钙钛矿。

文档核心知识点梳理
学习方法建议
- 按「功能结构类型」分类学习(AX₃/ABX₃/AB₂X₄),每个结构模块聚焦 “离子位置→化学式计算→配位特征→关键概念→性质应用” 逻辑链,避免知识点碎片化;
- 强制记忆「英文学术名词」,结合晶胞示意图(如 ReO₃的顶点 Re、棱上 O;钙钛矿的 A/B/X 位置)理解结构,而非死记硬背;
- 通过「习题自查」验证掌握程度,重点突破 “化学式计算、结构类型判断、性质与结构的关联” 三类高频考点。
模块 1:Rhenium Trioxide (ReO₃) Structure(AX₃结构)
重点 1:结构类型与晶胞离子排布(考试高频:化学式计算 + 堆积方式)
- 中文讲解:ReO₃属于 AX₃结构,其晶胞为简单立方(simple cubic, SC) 。其中,A 位阳离子(Re⁶⁺)位于立方体的 8 个顶点(corners of the cube),B 位阴离子(O²⁻)位于立方体的 12 条棱上(edges of the cube)。晶胞离子数计算:
- Re⁶⁺:8 个顶点 × 1/8(顶点原子归 8 个晶胞共有)= 1 个;
- O²⁻:12 条棱 × 1/4(棱上原子归 4 个晶胞共有)= 3 个;最终化学式为 ReO₃,符合 AX₃的 “A:X=1:3” 计量比。该结构的关键特征是晶胞中心有空位(vacancy) ,可嵌入其他离子(如 Na⁺)形成衍生化合物(如钨青铜 tungsten bronzes,如 NaₓWO₃)。
- 英文学术名词:Rhenium Trioxide (ReO₃);AX₃ structure;simple cubic unit cell (SC, 简单立方晶胞);cation (阳离子);anion (阴离子);unit cell (晶胞);vacancy (空位);tungsten bronzes (钨青铜);coordination number (配位数,CN)
- 自查习题:Calculate the number of Re⁶⁺ and O²⁻ ions in one unit cell of ReO₃, and confirm its chemical formula.(答案:Re⁶⁺: 8×1/8=1; O²⁻: 12×1/4=3; Chemical formula: ReO₃)
重点 2:配位框架(理解结构稳定性的核心)
- 中文讲解:ReO₃的晶体结构由顶点连接的 ReO₆八面体(vertex-linked ReO₆ octahedra) 构成:每个 Re⁶⁺被 6 个 O²⁻包围,形成正八面体(ReO₆),这些八面体通过顶点的 O²⁻彼此连接,构成三维框架。Re⁶⁺的配位数(coordination number)为 6,这是 AX₃结构的典型配位特征,也决定了其 “可嵌入离子” 的结构灵活性。
- 英文学术名词:coordination framework (配位框架);vertex-linked octahedra (顶点连接的八面体);ReO₆ octahedron (ReO₆八面体);coordination number (配位数,CN)
- 自查习题:What is the coordination number of Re⁶⁺ in ReO₃? What is the coordination polyhedron of Re⁶⁺?(答案:Coordination number: 6; Coordination polyhedron: ReO₆ octahedron)
模块 2:Perovskite Structure (ABX₃)(考试重中之重:结构 + 性质 + 应用)
重点 1:A-type/B-type 晶胞差异(核心:离子位置与化学式守恒)
- 中文讲解:钙钛矿(Perovskite)以 CaTiO₃为原型(prototype),属于 ABX₃结构:A 为大阳离子(如 Ca²⁺、CH₃NH₃⁺),B 为小阳离子(如 Ti⁴⁺、Pb²⁺),X 为阴离子(如 O²⁻、I⁻)。存在两种等效晶胞(equivalent unit cells) ,均为简单立方(primitive cubic),仅离子位置不同,但化学式始终为 ABX₃:
- B-type 晶胞:B 离子(如 Ti⁴⁺)在晶胞中心(center of unit cell),A 离子(如 Ca²⁺)在 8 个顶点,X 离子(如 O²⁻)在 6 个面心(faces);离子数:A=8×1/8=1,B=1×1=1,X=6×1/2=3;
- A-type 晶胞:A 离子(如 Ca²⁺)在晶胞中心,B 离子(如 Ti⁴⁺)在 8 个顶点,X 离子(如 O²⁻)在 12 条棱心(edges);离子数:A=1×1=1,B=8×1/8=1,X=12×1/4=3。
- 英文学术名词:Perovskite (钙钛矿);ABX₃ structure;prototype (原型);A-type unit cell (A 型晶胞);B-type unit cell (B 型晶胞);primitive cubic (简单立方,布拉维点阵类型);face-centered (面心的);edge-centered (棱心的);equivalent unit cells (等效晶胞)
- 自查习题:Compare the positions of A (Ca²⁺), B (Ti⁴⁺) and X (O²⁻) in A-type and B-type perovskite unit cells of CaTiO₃.(答案:B-type: B at unit cell center, A at corners, X at faces; A-type: A at unit cell center, B at corners, X at edges)
重点 2:Goldschmidt Tolerance Factor(戈德施密特容忍因子,判断结构稳定性)
- 中文讲解:容忍因子(t)是判断 ABX₃结构是否稳定的关键参数,公式为:\(t = \frac{r_A + r_X}{\sqrt{2}(r_B + r_X)}\)其中,r_A、r_B、r_X 分别为 A、B、X 离子的半径(ionic radii)。
- 当 t≈1 时,形成理想立方钙钛矿(ideal cubic perovskite) ,结构无畸变;
- 当 t 偏离 1 时,结构发生畸变(structural distortion) ,转变为低对称性结构(如菱形 rhombohedral、四方 tetragonal、正交 orthorhombic)。
- 英文学术名词:Goldschmidt tolerance factor (戈德施密特容忍因子,t);ionic radius (离子半径);ideal cubic perovskite (理想立方钙钛矿);structural distortion (结构畸变);rhombohedral (菱形的);tetragonal (四方的);orthorhombic (正交的)
- 自查习题:Given ionic radii: r_A=1.34 Å, r_B=0.61 Å, r_X=1.40 Å. Calculate the tolerance factor t of ABX₃ and judge if it forms an ideal cubic structure.(答案:t=(1.34+1.40)/[√2×(0.61+1.40)]≈2.74/2.84≈0.96≈1; It forms an ideal cubic structure.)
重点 3:Ferroelectricity(铁电性,钙钛矿核心性质)
- 中文讲解:铁电性(ferroelectricity)指材料在无外电场(external electric field) 时具有自发极化(spontaneous polarization) (即存在电偶极矩 electric dipole moment)。钙钛矿铁电性的成因:B 位阳离子(如 Ti⁴⁺)尺寸过小,无法在 BO₆八面体中对称分布,导致八面体畸变(distortion of BO₆ octahedron) ,B 离子偏离中心(off-center displacement),形成电偶极;相邻晶胞的电偶极定向排列(alignment of dipoles),使晶体产生净极化(net polarization) 。铁电性在居里温度(Curie Temperature, Tc) 以上完全消失,此时晶体转变为立方结构(cubic structure),不再具有自发极化。
- 英文学术名词:ferroelectricity (铁电性);spontaneous polarization (自发极化);electric dipole moment (电偶极矩);external electric field (外电场);off-center displacement (偏离中心位移);Curie Temperature (居里温度,Tc);net polarization (净极化);BO₆ octahedron (BO₆八面体)
- 自查习题:Explain why some perovskites show ferroelectricity, and what happens to their ferroelectricity when heated above Tc?(答案:Reason: Small B-site cations cause BO₆ octahedral distortion and off-center displacement, forming aligned dipoles with net polarization. Above Tc: Ferroelectricity is lost, and the structure becomes cubic.)
重点 4:Halide Perovskites for Solar Cells(卤化物钙钛矿,应用考点)
- 中文讲解:卤化物钙钛矿(halide perovskites)的 X 为 Cl⁻、Br⁻或 I⁻,A 常为有机阳离子(如甲基铵 CH₃NH₃⁺,methylammonium cation)或 Cs⁺,B 为 Pb²⁺或 Sn²⁺,典型代表为 CH₃NH₃PbI₃(MAPbI₃)。其作为太阳能电池(solar cells)光吸收层(light-harvesting layer) 的优势:
- 制备成本低(low cost),可通过溶液法(solution processing)或热蒸发(thermal evaporation)合成;
- 电子 / 空穴迁移率(electron/hole mobility)高,可与昂贵的 III-V 族半导体(如 GaAs)媲美;
- 太阳能电池效率(efficiency)已超过 25%。
- 英文学术名词:halide perovskites (卤化物钙钛矿);methylammonium cation (甲基铵阳离子,CH₃NH₃⁺);solar cell (太阳能电池);light-harvesting layer (光吸收层);solution processing (溶液法);thermal evaporation (热蒸发);electron/hole mobility (电子 / 空穴迁移率);III-V semiconductors (III-V 族半导体,如 GaAs);efficiency (效率)
- 自查习题:List two advantages of halide perovskites as the light-harvesting material in solar cells.(答案:1. Low cost and easy synthesis via solution processing/thermal evaporation; 2. High electron/hole mobility comparable to III-V semiconductors.)
模块 3:Spinel Structure (AB₂X₄)(重点:正常 / 反尖晶石判断 + 磁性)
重点 1:Normal Spinel(正常尖晶石,结构基础)
- 中文讲解:尖晶石(Spinel)以 MgAl₂O₄为原型,属于 AB₂X₄结构:A 为四面体配位阳离子(tetrahedrally coordinated,配位数 4),B 为八面体配位阳离子(octahedrally coordinated,配位数 6),X 多为 O²⁻或 F⁻。正常尖晶石(normal spinel)的结构特征:
- 阴离子(X)呈密堆积排列(close-packed array) ;
- A 离子占据 1/8 的四面体间隙(tetrahedral holes) ;
- B 离子占据 1/2 的八面体间隙(octahedral holes) ;晶胞为面心立方(face-centered cubic, FCC),Z=8(即 1 个晶胞含 8 个 AB₂X₄单元,如 Mg₈Al₁₆O₃₂)。
- 英文学术名词:Spinel (尖晶石);AB₂X₄ structure;normal spinel (正常尖晶石);tetrahedrally coordinated (四面体配位的);octahedrally coordinated (八面体配位的);close-packed array (密堆积排列);tetrahedral holes (四面体间隙);octahedral holes (八面体间隙);face-centered cubic (FCC,面心立方);unit cell content (Z,晶胞内容物)
- 自查习题:In a normal spinel AB₂X₄, what fractions of tetrahedral and octahedral holes are occupied by A and B cations?(答案:A occupies 1/8 of tetrahedral holes; B occupies 1/2 of octahedral holes.)
重点 2:Inverse Spinel 与 CFSE 判断(难点:晶体场稳定化能的应用)
- 中文讲解:反尖晶石(inverse spinel)的化学式常表示为 B (AB) X₄,核心特征是 A 离子取代一半 B 离子的位置:
- A 离子占据 1/8 的四面体间隙;
- 一半 B 离子占据剩余的四面体间隙,另一半 B 离子占据 1/2 的八面体间隙(即 A 和 B 均有四面体配位,B 同时有八面体配位)。判断正常 / 反尖晶石的关键是晶体场稳定化能(Crystal Field Stabilization Energy, CFSE) :比较 A 和 B 离子在四面体(tetrahedral)和八面体(octahedral)间隙中的 CFSE,CFSE 更大的间隙更稳定。示例:Fe₃O₄(磁铁矿 magnetite,化学式 Fe²⁺(Fe³⁺)₂O₄):
- Fe²⁺(d⁶弱场,weak field)在八面体间隙的 CFSE 更大(-6/5Δoct);
- Fe³⁺(d⁵弱场)在两种间隙的 CFSE 均为 0(无偏好);故 Fe³⁺占据四面体间隙,Fe²⁺和剩余 Fe³⁺占据八面体间隙,形成反尖晶石 Fe³⁺(Fe²⁺Fe³⁺) O₄。
- 英文学术名词:inverse spinel (反尖晶石);Crystal Field Stabilization Energy (CFSE,晶体场稳定化能);magnetite (磁铁矿,Fe₃O₄);weak field (弱场);tetrahedral site (四面体位置);octahedral site (八面体位置);d-electron configuration (d 电子构型)
- 自查习题:Use CFSE to explain why NiFe₂O₄ adopts an inverse spinel structure. (Hint: Ni²+ is d⁸ weak field; Fe³+ is d⁵ weak field)(答案:Ni²+ (d⁸ weak field) has higher CFSE in octahedral sites (-6/5Δoct) than tetrahedral sites (-4/5Δtet). Fe³+ (d⁵ weak field) has CFSE=0 (no preference). Thus, Fe³+ occupies tetrahedral sites, Ni²+ and Fe³+ occupy octahedral sites, forming inverse spinel Fe³+(Ni²+Fe³+) O₄.)
重点 3:Magnetic Properties(尖晶石磁性,应用考点)
- 中文讲解:尖晶石的磁性(magnetic properties)由离子未成对电子(unpaired electrons)的自旋耦合(spin coupling) 决定,且与结构(正常 / 反尖晶石)相关,主要分为两类:
- 亚铁磁性(ferrimagnetism) :四面体位置(tetrahedral sites)和八面体位置(octahedral sites)的离子磁矩(magnetic moments)方向相反,但大小不等,晶体具有净磁矩(net magnetic moment) ;示例:Fe₃O₄、CoFe₂O₄(用于磁记录介质 magnetic recording media)、NiFe₂O₄(用于偏转磁铁 deflection magnets)。
- 英文学术名词:magnetic properties (磁性);ferrimagnetism (亚铁磁性);antiferromagnetism (反铁磁性);magnetic moment (磁矩);net magnetic moment (净磁矩);unpaired electrons (未成对电子);spin coupling (自旋耦合);magnetic recording media (磁记录介质);deflection magnets (偏转磁铁)
- 自查习题:What is the difference between ferrimagnetic and antiferromagnetic spinels? Give one example of a ferrimagnetic spinel.(答案:Difference: Ferrimagnets have opposite magnetic moments of unequal magnitude (net moment); antiferromagnets have opposite moments of equal magnitude (no net moment). Example: CoFe₂O₄ (or Fe₃O₄, NiFe₂O₄))
0 条评论