分子轨道理论是原子轨道的线性组合,而AO叠加本质是波函数的线性叠加.
在轨道能量方面,价键理论认为共价键的本质是原子轨道重叠,共用自旋相反的电子对使轨道能量降低;而MO的能量可以低于、等于或高于AO.
总的来说,分子轨道理论具有更完善的数学形式,可以很好地解释$O_2$的顺磁性,离域电子体系的结构和性质,证明分子的存在性以及判断其稳定性($He, H_2^{+}$等)
波函数叠加方式
根据MO理论,波函数叠加方式有两种:
1. 同相叠加:波增强,轨道能量降低,形成成键轨道(bonding molecular orbital)
2. 反相叠加:波相消,轨道能量升高,形成反键轨道(antibonding molecular orbital);出现电子云密度始终为0的节面(node)
键级
成键分子轨道每比反键分子轨道多填入一对电子,两个原子之间就会形成一根键;两个原子之间成键的数目称为键级(bond order)
能量相近的AO才能够叠加,而AO叠加方式影响MO能级顺序.
分子轨道能级顺序
同核双原子的分子轨道
根据AO能量差,有以下几种叠加方式:
1. s-s叠加
2. p-p叠加
3. s-p混杂
异核双原子的分子轨道
在HF分子中,H的$1s$轨道(–13.4 eV)和F 的$2p$轨道(–17.4 eV)能量相近,$p_x$和$s$头碰头地叠加形成$\sigma_{sp}$分子轨道,剩下的$p_y$和$p_z$没有成键、轨道能量不变,记作非键轨道.
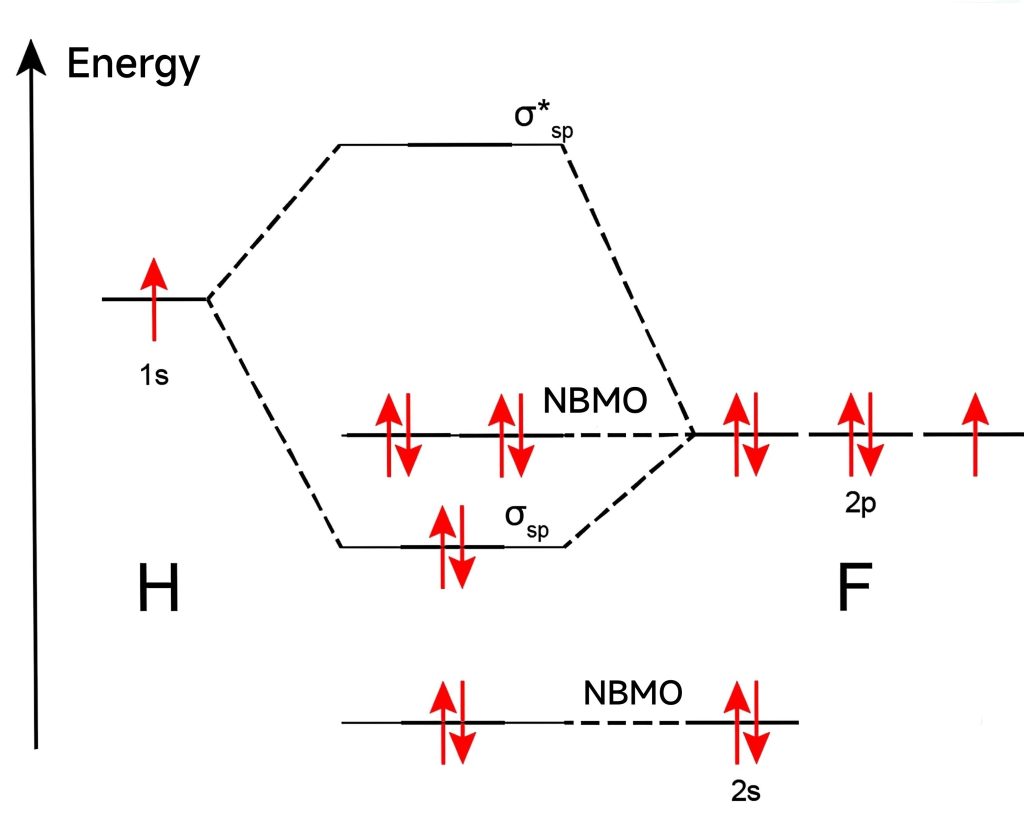
其中,电负性更大的原子,AO能量更低.
多原子分子的分子轨道
对于结构比较简单的分子,可以仿效VB理论,用杂化轨道来简化MO轨道的处理.
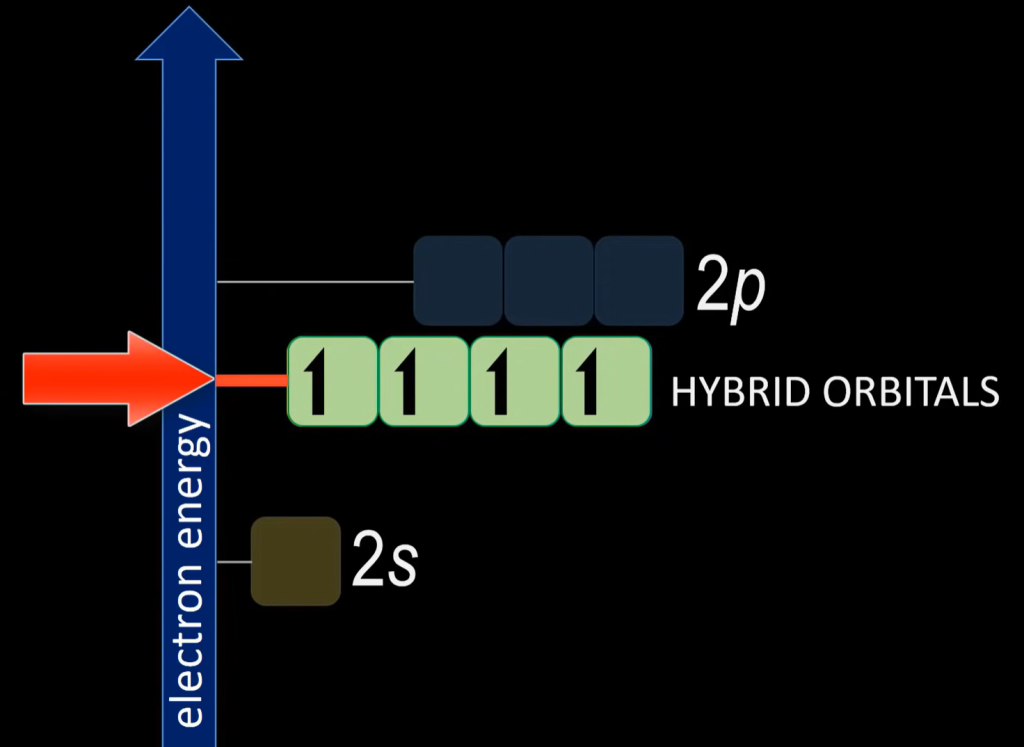
- $CH_4$
以$CH_4$为例,$C$的1个$2s$和3个$2p$轨道杂化,形成4个能量相同的$2sp^3$杂化轨道,分别与$H$相连,键角$109.5^{\circ}$:
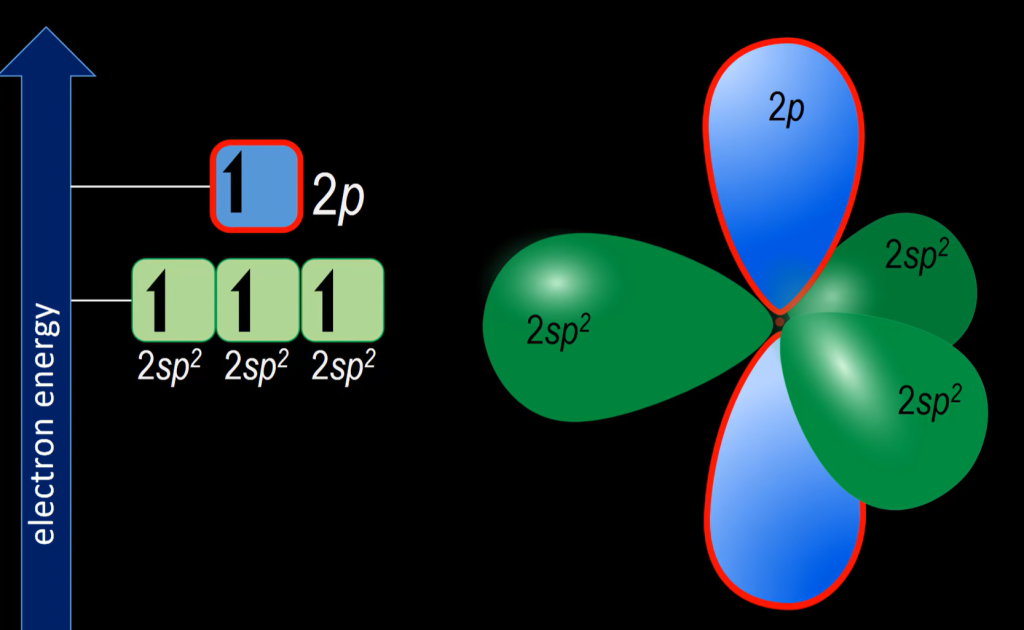
- $C_2H_2$
$\pi$键来自未杂化的$p$轨道的overlap,因此$C$仅有1个$2s$轨道和2个$p$轨道参与杂化:
Reference
0 条评论