热力学是研究热力学过程中热与功的转化关系与条件的.
理想气体的每一个平衡态,都可以用$p-V$图上的一个点来表示;而简单系统的准静态过程,则可以用$p-V$图上的一条曲线表示.
基本概念
内能$E$:状态量
$$E=\frac{M}{\mu}\frac{i}{2}RT$$
气体系统内部所具有的能量,是状态量(即只与气体所处的状态有关)
功$A$:过程量
$$A=\int_{V1}^{V2}pdV$$
气体从一种状态$(V_1,p_1)$到另一种状态$(V_2,p_2)$,系统对外所做的功(有正负之分)
热量$Q$:过程量
$$Q=\frac{M}{\mu}C_m(T_2-T_1)$$
气体系统与外界之间,由于有温差 而传递的能量.
其中$C_m$为摩尔热容,即1$\text{mol}$的某种物质升高(或降低)$1\text K$所需要吸收(或放出)的热量,单位$\text J/(mol\cdot K)$
- 同种物质在同样温度下的摩尔热容,随过程不同而变化
同温度下,若要使气体保持压强不变而升高$1\text K$,所吸收的热量要比使其保持体积不变而升高$1\text K$要多,因为等压升温要求体积变大,要对外做功. - 同种物质在同过程中的摩尔热容,随温度的不同而变化
一般近似认为摩尔热容是关于温度的常数
热力学基本定理
热力学第一定律
$$Q=\Delta E+A$$
系统从外界吸收的热量,一部分增加了气体的内能,一部分用于对外做功
- $Q+$:系统从外界吸热;$Q-$:系统向外界放热
- $E+$:系统的内能增加,温度升高;$E-$:系统的内能减少,温度降低
- $A+$:系统对外做功(做正功);$A-$:外界对系统做功(做负功)
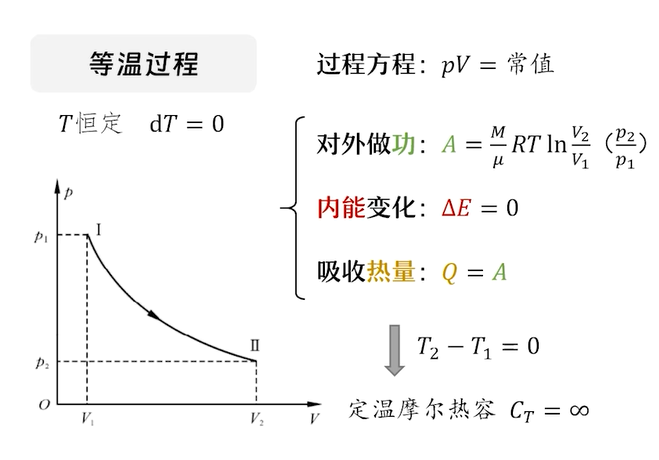
三种等值过程

摩尔热容是根据热力学第一定律的公式$Q=\Delta E+A$列出的三个方程,而进一步求解得到的.
- 比热容比
$$\lambda=\frac{C_p}{C_v}=\frac{2+i}{i}$$
- 迈耶公式
$$C_p=C_v+R$$
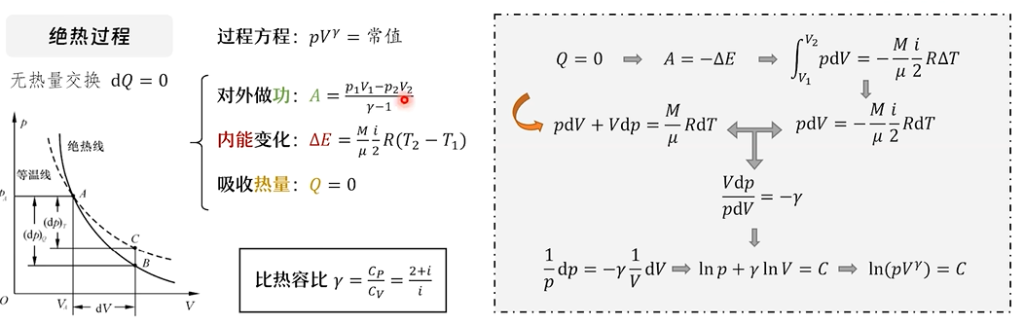
绝热过程与多方过程
热传递
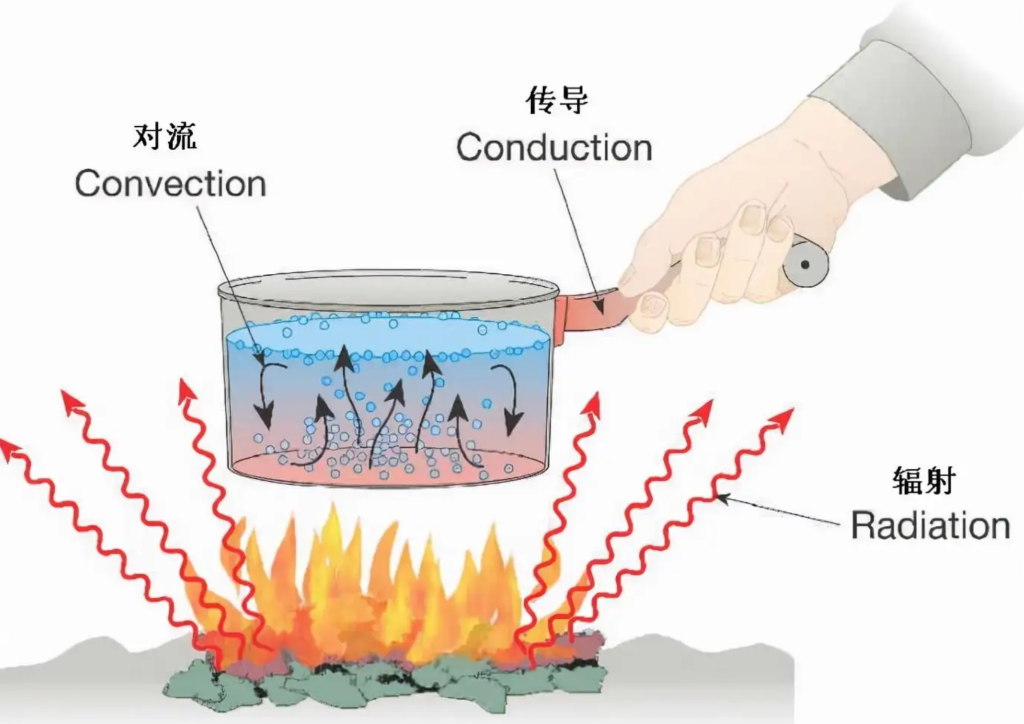
导热基本定律 Fourie’s law of heat conduction
$$
q=-\lambda\frac{\partial T}{\partial x}
$$
$$
\vec{q}=-\lambda\frac{\partial T}{\partial n}\vec{n}=-\lambda\nabla T
$$
负号代表热量传递方向与温度升高的方向相反.
热传导 Fouriw’s law
$$ \Phi =-\lambda A\frac{T_1-T_2}{L} $$
其中$\Phi$为热流量
热辐射 Stefan-Boltzmann
$$E=\sigma T^4$$
其中,$E$是单位时间上辐射的总能量,$T$是黑体的绝对温度,$\sigma=5.67\times 10^{-8}W/m^2\cdot K^4$是斯蒂藩-玻耳兹曼常数.
斯蒂藩-玻耳兹曼定律表明$E\propto T^4$,即物体的温度越高,辐射的总能量就越大.
0 条评论